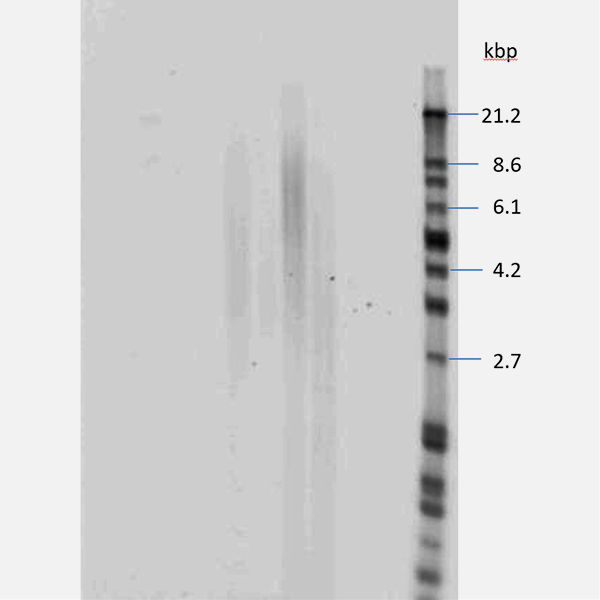
サザンブロット法による研究
テロメア研究においては、まずその長さを知ることが重要です。テロメア長の測定方法はサザンブロット法が標準的測定法です。細胞は分裂に伴いテロメアが約100bp短縮します。このため、組織のDNAを抽出して測定すれば、老化に伴うテロメアの短縮が明らかになると考えました。
私たちが測定した人体の組織の種類はおよそ20種類になります。サザンブロット法によるテロメア長の測定により、組織内のテロメアは非常に長さに差があることがわかりました。
論文業績紹介
-
- メダカのテロメアの短縮と回復には、各ライフステージでの成長率とテロメラーゼ活性が関与
Telomere attrition and restoration in the normal teleost Oryzias latipes are linked to growth rate and telomeraseactivity at each life stage. Hatakeyama H, Yamazaki H, Nakamura K, Izumiyama-Shimomura N, Aida J, Suzuki H, Tsuchida S, Matsuura M, Takubo K, Ishikawa N. Aging (Albany NY). 2016 Jan;8(1):62-76.
-
テロメアの短縮は、in vitro, in vivoの両方の状態で細胞が分裂するときに起こりますが、テロメラーゼは、テロメアの末端にTTAGGGリピートを追加することにより、細胞内のテロメア長を維持しています。しかしながら、テロメアの長さ、テロメラーゼ活性および脊椎動物の成長の相互関係は明らかにされていません。本研究では、テロメアの長さ、テロメラーゼ活性、および胚期から老化までのメダカの体長と体重を測定しました。急速な成長段階(0~7ヶ月)では、テロメラーゼ活性の低下とともにテロメア長が短くなりました。その後、青年期(7ヶ月~1年)で、成長が遅くなりテロメラーゼ活性が増加するにつれて、テロメア長が急速に長くなりました。わずかな成長を特徴とする成人期(1〜4歳)では、テロメラーゼ活性は徐々に低下し、テロメア長は短縮しました。我々のデータは、テロメア長の短縮と回復が成長とテロメラーゼ活性に関連していることを示しており、テロメアの恒常性の重大な損失がこの動物の死に関連していることを示唆しています。
-
- ヒト心筋細胞のテロメア長は加齢と心疾患で短縮する
Association of telomere shortening in myocardium with heart weight gain and cause of death. Masanori Terai, Naotaka Izumiyama-Shimomura, Junko Aida, Naoshi Ishikawa, Motoji Sawabe, Tomio Arai, Mutsunori Fujiwara, Akio Ishii, Ken-Ichi Nakamura, & Kaiyo Takubo. Scientific Reports 2013; 3: srep02401, http://www.nature.com/srep/2013/130809/srep02401/full/srep02401.html
-
病理解剖を行った530人の患者様から心臓の壁の筋肉(心筋)のDNAを抽出し、サザンブロット法を用いてテロメア長を測定した結果、心筋のテロメアは加齢によって短縮することを証明しました。さらに、テロメア長のデータを死因別(がん、心疾患、それ以外の疾患)に比較した結果、死因が心疾患の患者様の心重量は、がんやそれ以外の疾患の患者様と比較して増加していました。さらに、死因が心疾患である患者様の心筋のテロメアはがんの患者様と比較すると短縮していました。以上の結果をまとめると、(1)加齢に伴い心筋のテロメアは短縮すること、(2)心疾患により心臓の重量は増加すること、(3)死因が心疾患の心筋のテロメアは、がんと比較して短縮していることが判明しました。 今回の論文の注目点は、心疾患における心重量の増加とテロメアの短縮との関連です。高血圧など心臓に対して負荷がかかると心筋細胞の肥大がおこることは良く知られていますが、それ以外にも、従来から存在が指摘されていた心筋の組織幹細胞が活性化する可能性や、すでに分化していて分裂しない細胞といわれてきた心筋細胞が分裂する可能性も推察されました。テロメアの生物学により、心筋細胞の肥大、組織幹細胞を含めた心筋細胞の再生の機構が解明され、将来的にはiPS細胞や間葉系幹細胞などにを用いた細胞移植医療による心疾患の治療や、予防法の確立などの研究の進展に大きく貢献できると確信しています。
-
- ヒト下垂体テロメア長は百寿者に至るまでよく保存される
Telomere length dynamics in the human pituitary gland: robust preservation throughout adult life to centenarian age. Naoshi Ishikawa, Ken-Ichi Nakamura, Naotaka Izumiyama,Junko Aida, Motoji Sawabe, Tomio Arai, Hiroshi Kishimoto, Mutsunori Fujiwara, Akio Ishii, and Kaiyo Takubo. Telomere length dynamics in the human pituitary gland: robust preservation throughout adult life to centenarian age. AGE 2012; 34: 795-804
-
病理解剖された患者様(0〜100歳)から得られた下垂体のテロメア長をサザンブロット法で検出し、加齢に伴うテロメアの変化を解析しました。その結果、下垂体のテロメアは新生児期では諸臓器中で最も長く、年間短縮率も他臓器と比べ(大脳灰白質を除き)最も小さいことがわかりました。つまり、他の臓器と比較して生涯を通じて最も長いテロメアを持っていることを明らかにしました。テロメアの短縮は新生児期から60歳までの間に起こりその後は有意な減少は起こらないこと(むしろ高齢者ほど長くなる傾向を示す)、細胞の増殖期のマーカーであるKi-67が陽性である細胞は、胎児期から新生児期にかぎられることもわかりました。以上から、下垂体でのテロメア短縮は生後早期のうちに起こることが推測され、個体特有のテロメア長の指標として有用であると考えられます。また、細胞内や染色体内で差の大きなテロメアの長さの代表値について検討し、サザンブロット法によるシグナル強度のピーク値と中央値(median)がよく相関すること、平均値(mean)は、ほぼ一定の幅で中央値(median)より大となるため、両者それぞれから求めた年間短縮率はほぼ同じになることを明らかにしました。これらのデータはこれ迄に世界中の研究室で蓄積されたテロメア長データを比較するうえで重要な基礎データを提供することになります。
-
- ウェルナー症候群の患者の皮膚でテロメア短縮が加速している
Accelerated in vivo epidermal telomere loss in Werner syndrome. Naoshi Ishikawa, Ken-ichi Nakamura, Naotaka Izumiyama-Shimomura, Junko Aida, Akio Ishii, Makoto Goto, Yuichi Ishikawa, Reimi Asaka, Masaaki Matsuura, Atsushi Hatamochi, Mie Kuroiwa, Kaiyo Takubo. Aging (Albany NY) 2011; 3: 417-429
-
ウェルナー症候群(WS)はウェルナーヘリカーゼ遺伝子の変異により発症する疾患です。思春期以降に加齢と関係する症状(白髪、皮膚の萎縮、動脈硬化、骨粗鬆症など)を通常よりも若い年齢から発症します。代表的な早老症で、老化のメカニズムを解明するモデルとして注目されてきました。難治性の潰瘍のため手術された患者皮膚および骨格筋のテロメア長をSouthern blot法により測定し、コントロール群との関係を解析しました。WS患者皮膚組織において、30歳代以降、正常人群と比べテロメア長が急速に短縮(25歳相当早まる)すること、一方骨格筋組織では出生早期からテロメア長が有意に短縮していることを明らかにしました。これはWS患者の生体内(in vivo)でのテロメア長動態について世界初の報告で、テロメア維持機構の破綻がWS発症の基盤の一つとなることを強く示唆します。WS患者における若年での肉腫の発症や中年以降の癌腫の多発とテロメア短縮との関連を初めて統計学的に示したことも注目されます。
-
- 脳のテロメア長は死因と関連している
Telomeric DNA length in cerebral gray and white matter is associated with longevity in individuals aged 70 years or older. Ken-Ichi Nakamura, Kaiyo Takubo, Naotaka Izumiyama-Shimomura, Motoji Sawabe, Tomio Arai, Hiroshi Kishimoto, Mutsunori Fujiwara, Motonobu Kato, Mitsuo Oshimura, Akio Ishii and Naoshi Ishikawa. Exp Gerontol, 2007; 42: 944-950 (さらに…)
大脳は神経細胞を含む灰白質と神経細胞を含まない白質とからなっています。生後神経細胞はほとんど分裂しないことから、灰白質のテロメアは誕生時の長さを白質よりも維持していると考えられています。両者のテロメア長を測定し、死因との関係を解析すると、がん死はテロメアの短い群に多いことがわかりました。ヒトの組織を用いて死因との関係を検討した論文として老化に関する英文総説の中で半ページも引用されるなど、高い評価を受けました。
-
- テロメアの長さは全ての組織で個人特有の長さを持つ
Telomere lengths are characteristic in each human individual. Kaiyo Takubo, Naotaka Izumiyama-Shimomura, Naoko Honma, Motoji Sawabe, Tomio Arai, Motonobu Kato M, Mitsuo Oshimura, Ken-ichi Nakamura. Exp Gerontol. 2003; 37: 523-531.
Kaiyo Takubo, Naotaka Izumiyama-Shimomura, Naoko Honma, Motoji Sawabe, Tomio Arai, Motonobu Kato M, Mitsuo Oshimura, Ken-ichi Nakamura. Telomere lengths are characteristic in each human individual.
ヒト組織は細胞から構成され、細胞核内の染色体の末端には、命の回数券と呼ばれるテロメアがあります。各組織のテロメアは、一つの組織で長い時、他の組織でも長いことをこの論文で証明しました。長いテロメアは染色体を安定に保つことに必須で、染色体の不安定性が「がん」への入り口と考えられます。以上からはテロメアの長いヒトは「がん」にかかりにくいことが考えられます。テロメアを測定することにより、がん化のリスクを判定できるようになるかもしれません。
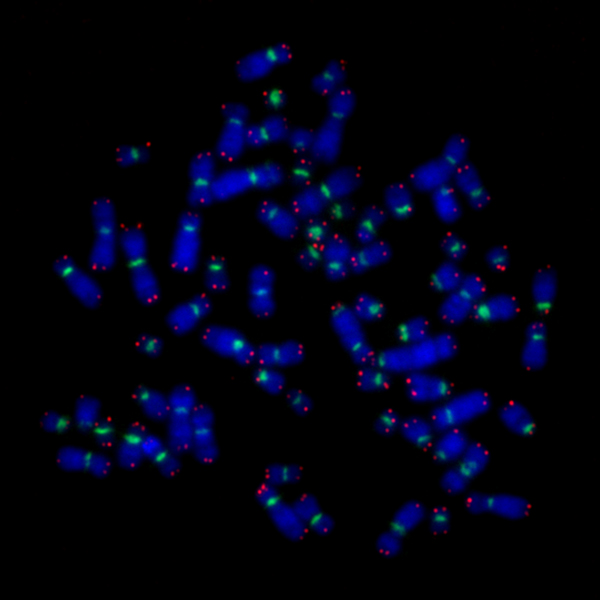
染色体FISH法による研究
ヒト細胞は46本の染色体を持っています。老化や疾患の発生と関連して、特有な染色体のテロメアが短いのではないかと考え、染色体の長・短腕ごとのテロメアの長さを測定しました。
特異的にテロメアに結合するプローブに、蛍光物質を付加し、その蛍光光度を測定し、テロメア長に換算して、テロメアの長さを知ることができます。蛍光光度とサザンブロット法のデータをキャリブレーションすることにより、実際のテロメア長を測定することができます。癒合、消失や分裂後期架橋などの染色体の不安定性の形態学的指標を持つ染色体では、テロメアが短いことがわかりました。
論文業績紹介
-
- 18番染色体トリソミー、21番染色体トリソミー(ダウン症候群)新生児でテロメア短縮は起こっていない
Telomere Lengths at Birth in Trisomy 18 and 21 Measured by Q-FISH. Ken-ichi Nakamura, Naoshi Ishikawa, Naotaka Izumiyama, Junko Aida, Mie Kuroiwa, Naoki Hiraishi, Mutsunori Fujiwara, Atsushi Nakao, Tadashi Kawakami, Steven SS Poon, Masaaki Matsuura, Motoji Sawabe, Tomio Arai, and Kaiyo Takubo. Gene 2014 Jan 1;533(1):199-207.
-
21番染色体トリソミーが原因であるダウン症候群は、テロメア短縮による染色体不安定性(染色体癒合や欠失)が誘因となることが強く疑われています。また、早老症を呈することで知られるダウン症候群においてテロメアは正常者と比べ急速に短縮するとの報告がされています。しかしながら、出生直後のテロメア長に関する報告は今迄ありませんでした。今回私達は、核型正常2倍体、18番染色体トリソミーおよび21番染色体トリソミーの3群の新生児の末梢血リンパ球の染色体ごとのテロメア長をQ-FISH法により計測しました。その結果、1)トリソミー責任染色体のテロメアは全染色体平均テロメア長と細胞内で比較して有意差はないこと、2)トリソミー群と二倍体群との群間比較でテロメア長に差は認められないこと、を明らかにしました。また、テロメア長既知の細胞(TIG-1)を検体スライド上に展開して同時に測定することにより、検体のテロメア長の正確な校正値を得る手技を確立しました。以上のことから、短縮テロメアは受精後の発生中のリプログラミングにより補正的に伸長されて正常域にあること、テロメア短縮を来さないように患児を生後管理することの重要性が示唆されました。
-
- テロメアの短い膀胱癌が組織学的悪性度が高い癌に進行する
Short telomeres and chromosome instability prior to histologic malignant progression and cytogenetic aneuploidy in papillary urothelial neoplasms. Naotaka Izumiyama-Shimomura, Ken-ichi Nakamura, Junko Aida, Naoshi Ishikawa, Mie Kuroiwa, Naoki Hiraishi,Mutsunori Fujiwara, Yuichi Ishikawa, Naoko Inoshita, Junji Yonese, Masaaki Matsuura, , Steven SS Poon, Tomio Arai, Kaiyo Takubo.Urol Oncol 2014; 32: 135-145.
-
乳頭状に膀胱の中に突出する膀胱癌の悪性度は、組織像(顕微鏡で見た癌組織や細胞の様子)により3種類に分類されています。最も悪性度が低い型は、細胞核内の染色体数は正常と同じく46本でした。これは切除で治ります。悪性度が中間の型は46本未満であることが多く、最も悪性度の高い型は46本よりも多いことがわかりました。この一連の組織像の悪性化と染色体数の変化の過程よりも前に、テロメアの短縮と染色体の不安定性がすでに起きていることを本論文は証明しました。以上の結果から、テロメアが短く染色体の不安定性のある癌は、悪性度の高い癌に早期になることが予想されました。
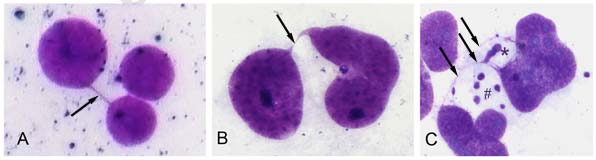 図:3群の膀胱癌培養細胞中に見られた分裂後期架橋の代表的な像。(A)悪性度の低い型 (B)悪性度が中間の型 (C)悪性度の高い型 糸状の染色体(ストリング: 矢印)にブレブ(★)の形成が見られ、多数の微小核(#)が認められる。
図:3群の膀胱癌培養細胞中に見られた分裂後期架橋の代表的な像。(A)悪性度の低い型 (B)悪性度が中間の型 (C)悪性度の高い型 糸状の染色体(ストリング: 矢印)にブレブ(★)の形成が見られ、多数の微小核(#)が認められる。
-
- 染色体の癒合はテロメアの短い染色体から始まり分裂後の娘細胞の不分離の原因となる
Chromosomal instability and telomere lengths of each chromosomal arm measured by Q-FISH in human fibroblast strains prior to replicative senescence. Kaiyo Takubo, Junko Aida, Naotaka Izumiyama, Naoshi Ishikawa, Mutsunori Fujiwara, Steven SS Poon, Hiroshi Kondo, Makoto Kammori, Masaaki Matsuura, Motoji Sawabe, Tomio Arai, Duncan M Baird, Ken-ichi Nakamura. Mech Age Dev. 2010; 131: 614-624.
-
本研究所で作られたヒトの線維芽細胞7株を細胞分裂が停止するまで培養しテロメア長を経時的に染色体別に計測しました。測定には定量的蛍光インサイチューハイブリダイゼイション法を用いました。分裂が止まる直前に出現した癒合した染色体(染色体不安定性の指標)のテロメアは有意に短縮していました。また染色体不分離像である細胞分裂の後期−終期ブリッジ(架橋)の頻度はテロメア短縮と相関し、架橋中にテロメアが過度に短縮した染色体があることを証明しました。テロメア長短縮率、短縮する染色体番号などに細胞株の個性があることを明らかにした点も独創的であり本研究の画期的な点です。
図1
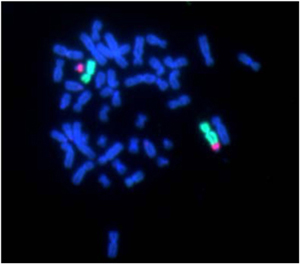 図2
図2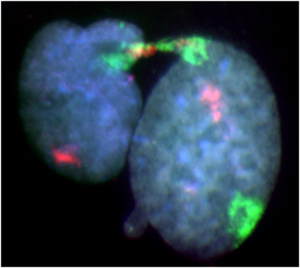
図1:
TIG-1細胞のホールクロモゾームペインティング法による分裂中・後期架橋像。赤はX染色体、緑は21番染色体です。核は完全に分裂せず糸状の核線で繋がっています。繋がった部分にはX染色体と21番染色体とが存在しています。両染色体は定量的FISH法によるテロメア長測定で、テロメアが過度に短縮していました。(Mech Age Dev 2010; 131: 614-624)
組織切片FISH法による研究
サザンブロット法によりテロメア長を測定するためには、細胞や組織を破壊してDNAを取り出して測定します。組織は何種類もの異なる細胞からできています。このため、1種類の細胞のテロメア長を知ることはできません。
組織切片を用いるFISH法では、細胞の種類別にテロメア長を測定できます。病理診断に用いる組織切片と同じ切片上で、テロメアとセントロメアに対する蛍光付加プローブをハイブリダイズします。両者の蛍光光度比からテロメア長を知ることができます。病理組織学的知識を基礎に、顕微鏡による観察に基づき組織中の特別な部分や細胞種におけるテロメアの短縮の有無を知ります。この方法により、がんの周囲のテロメア長は、がんのない人よりも短縮していることを証明しました。
論文業績紹介
-
- Accelerated telomere shortening in adrenal zona reticularis in patients with prolonged critical illness.
Accelerated telomere shortening in adrenal zona reticularis in patients with prolonged critical illness. Keisuke Nonaka, Kaiyo Takubo, Junko Aida, Yoriko Watai, Akiko Komatsu, Fujiya Gomi, Yuuki Shichi, Yuto Yamazaki, Toshiyuki Ishiwata, Hironobu Sasano, Tomio Arai. Front Endocrinol (Lausanne). 2023 Sep 4;14:1244553. https://www.frontiersin.org/articles/10.3389/fendo.2023.1244553/full
-
- Telomere lengths in Barrett’s esophagus as a precancerous lesion.
Telomere lengths in Barrett’s esophagus as a precancerous lesion. Junko Aida, Kaiyo Takubo, Michael Vieth, Horst Neuhaus, Mutsunori Fujiwara, Tomio Arai, Toshiyuki Ishiwata. Esophagus. 2021 Sep 24. doi: 10.1007/s10388-021-00884-4.
-
- 高齢期の副腎の重量とテロメア長は男性で減少し、女性では変化しない
Correlation between Telomere Attrition of Zona Fasciculata and Adrenal Weight Reduction in Older Men. Keisuke Nonaka, Junko Aida, Kaiyo Takubo, Yuto Yamazaki, Xin Gao, Akiko Komatsu, Shoichiro Takakuma, Mototsune Kakizaki, Naoko Inoshita, Toshiyuki Ishiwata, Ja Mun-Chong, Tomio Arai, Hironobu Sasano. J Clin Endocrinol Metab. 2019 Nov 20.
-
国や人種に関係なく女性が男性よりも長命であることが知られていますが、その背景にある細胞学的・分子生物学的なメカニズムは解明されていません。すべての細胞の染色体末端にはテロメアという構造が位置し、染色体を変性・消失などから保護しています(図1)。このテロメアがある一定レベルより短くなると、細胞は壊れやすくなります。血液細胞のテロメア長は若い世代から女性の方が長いため、このテロメア長の差が男女の寿命差につながるという説がこれまで有力でした。しかし、高齢になると血液細胞テロメア長の男女差が小さくなるため、これだけでは説明できません。私たちは、生命活動に重要な様々なホルモンを合成・分泌する副腎のテロメア長の男女差に注目し研究してきました。副腎は左右腎臓の上方にそれぞれ1個ずつ位置する小さな臓器です(図2)。特に、副腎の大半の体積を占める束状層という領域からは抗炎症作用・抗ストレス作用など生命活動に極めて重要なホルモンが合成・分泌されています。本研究の結果、65歳以上の高齢期では男性の副腎重量は減少する一方、高齢女性の副腎重量には変化がみられないことが明らかになりました。また、高齢期では女性に比べて男性の方が上述の束状層という領域のテロメアが短いことが分かりました。以上の結果から、高齢男性の副腎では束状層細胞のテロメア減少が細胞変性・脱落を引き起こし、副腎重量を減少させていると考えられます。束状層細胞は生命活動に極めて重要なホルモンを分泌することから、高齢男性における束状層細胞の減少は、男女の寿命差に関係している可能性があります。今回、未解明な点が多い男女の寿命差が副腎のテロメアと関連する可能性を世界で初めて報告しました。
-
- 副腎皮質3層各々の分化とテロメア長は相関する
Correlation between Differentiation of Adrenocortical Zones and Telomere Lengths measured by Q-FISH. Keisuke Nonaka, Junko Aida, Kaiyo Takubo, Yuto Yamazaki, Shoichiro Takakuma, Matotsune Kakizaki, Yoko Matsuda , Naoshi Ishikawa, Toshiyuki Ishiwata, Ja-Mun Chon, Tomio Arai, Hironobu Sasano. J Clin Endocrinol Metab. 2019 Jun 20.
-
以前我々は、幹細胞群がより分化した細胞群へ移行するにつれてテロメア長が徐々に減少することを報告しました(Aida J, et al. Basal cells have longest telomeres measured by tissue Q-FISH method in lingual epithelium. Exp Gerontol2008; 43: 833-9)。すなわち、テロメア長は細胞老化に加えて、細胞分化の指標と考えることも可能です。
副腎皮質の3層各々から合成・分泌されるホルモンの生体に対する重要度や各ホルモン分泌をコントロールするフィードバック機構の有無等から、ZF(束状層)が皮質3層の中で最も分化した層、ZR(網状層)が最も未分化な層、ZG(球状層)が両者の中間であることが推定されます。本研究では、ヒト副腎皮質3層の実質細胞のテロメア長を層別に組織Q-FISH法で測定し、各々の層の機能的・形態的分化とテロメア長が相関することを世界で初めて示しました。本研究成果が、副腎皮質の層構造発達異常疾患(原発性副腎低形成症など)の病因・機序解明の一助となることが期待されます。
-
- 病理解剖128症例の下垂体の標本を用いて、組織Q-FISH法で下垂体の前葉、後葉のテロメア長を測定
Quantitative fluorescence in situ hybridization for investigation of telomere length dynamics in the pituitary gland using samples from 128 autopsied patients. Hiraishi N, Terai M, Fujiwara M, Aida J,Izumiyama-Shimomura N, Ishikawa N, Tomita K, Matsuda Y, Arai T, Takubo K, Ishiwata T.Tissue Cell. 2018 Aug;53:1-7.
-
病理解剖を行った128症例(男性65症例、女性63症例)の下垂体の検体を使って、組織Q-FISH法で下垂体の前葉(腺性)、後葉(神経性)のテロメアの長さを測定しました。その結果、下垂体の前葉と後葉の間にはテロメアの短縮において、大きく三つの新しい現象が明らかにされました。一つ目は、下垂体の前葉は加齢と共にテロメアは短縮する(細胞分裂する)のに対し、後葉は短縮しない(細胞分裂しない)ことがわかりました。二つ目は、女性の後葉のテロメアは、男性と比較して有意に長いことがわかりました。三つ目は、80〜90歳代の症例の下垂体の検体は70歳代の検体と比較して、テロメアが長い傾向にあることがわかりました。このことは、従来から言われていることですが、長いテロメアを持つヒトの方が寿命が長いことを裏付けることになります。
この論文は、組織Q-FISH法で下垂体のテロメアの長さを測定することにより、下垂体の前葉と後葉のテロメアの短縮に関する新規の知見の報告になります。この研究は、将来的に一般的な医療となる再生医療の中で、一番難しいとされるホルモン産生細胞の細胞治療の開発に大きく貢献することになると考えられます。
-
- テロメアの短い膵管上皮から前がん病変(PanIN)、さらに膵がんが発生する
Gradual telomere shortening and increasing chromosomal instability among PanIN grades and normal ductal epithelia with and without cancer in the pancreas. Matsuda Y, Ishiwata T, Izumiyama-Shimomura N, Hamayasu H, Fujiwara M, Tomita K, Hiraishi N, Nakamura K, Ishikawa N, Aida J, Takubo K, Arai T. PLoS One 2015; 10: e0117575
-
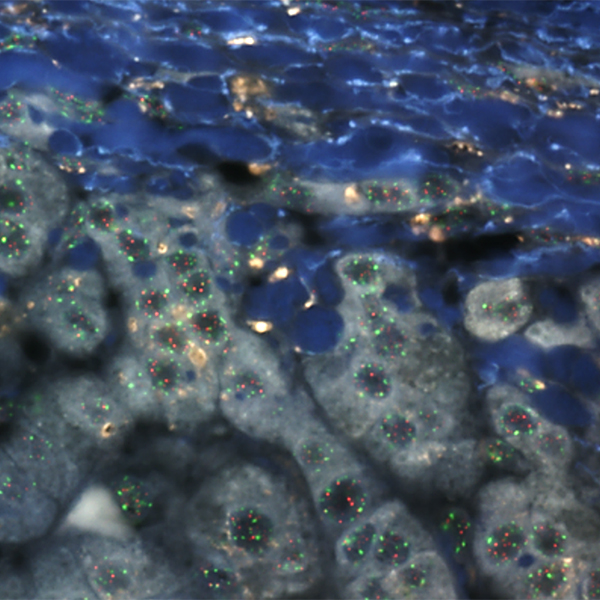
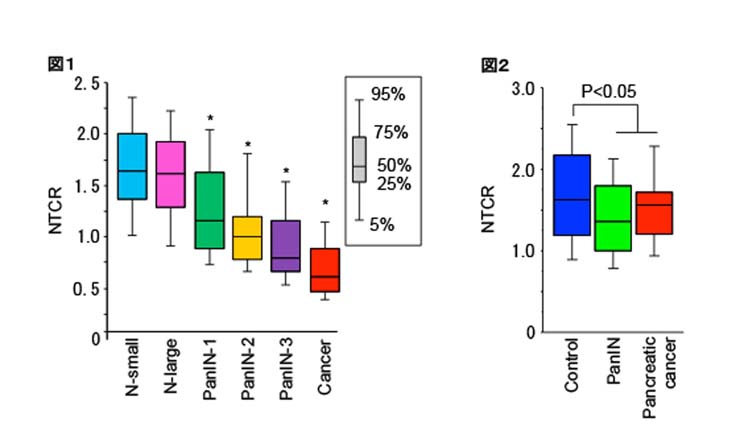
本研究では、膵がんのある人の膵臓、膵がんの前がん病変といわれるPancreatic intraepithelial neoplasia=PanINのある人の膵臓を標本として、組織Q-FISH法でテロメア長を求め、がんや前がん病変のない人の膵臓と比較して、膵がんが発症する過程においてテロメア長が短くなることを証明しました。PanINや膵がんでは正常の膵管(膵臓で膵液の分泌される管:膵がんの発生する場所といわれている)よりもテロメアが短くなっており(図1)、膵がんのある人ではがんのない人の膵臓よりもテロメアが短くなっていました(図2)。テロメアが短くなりテロメアの機能不全が起きた膵管上皮が、膵前がん病変、膵がんの発生母地となると考えられます。この現象はこれまで私たちの研究グループにおいて口腔や食道、皮膚で証明してきたと同様に、テロメアの短縮により染色体の不安定性が高まることで、発がんに繋がることを示し、扁平上皮ばかりでなく膵臓においても共通の現象が起きていることを証明しました。
解説:正常の膵管 (N-small, 小さな膵管; N-large, 大きな膵管) と膵の前がん病変(PanIN-1; 異形の軽い病変, PanIN-2; 異形の中等度の病変、PanIN-3; 異形の強い病変)、膵がん(Cancer)のテロメア長の解析結果を箱ヒゲグラフで表したものです。 PanINの悪性度が進行するに従ってテロメア長は短くなり、膵癌ではテロメア長の著明な短縮がみられます(図1)。さらに、同じような年齢になるよう調整した正常対照群と比べて、膵がんやPanINを有するヒトの腫瘍以外の膵管上皮はテロメア短縮が起きていることがわかります(図2)
-
- 口腔前がん病変はテロメアの短い老化した細胞からできている
Short telomeres in an oral precancerous lesion: Q-FISH analysis of leukoplakia. Junko Aida, Takanori Kobayashi, Takashi Saku, Masatsune Yamaguchi, Naotaka Shimomura, Ken-ichi Nakamura, Naoshi Ishikawa, Satoshi Maruyama, Jun Cheng, Steven SS Poon, Motoji Sawabe, Tomio Arai, Kaiyo Takubo. J Oral Pathol Med. 2012; 41: 372-378
-
扁平上皮がんを併発しやすい口腔内の白板症(肉眼で白く見える病変)のテロメアが短い(老化が進んでいる)ことを証明しました。これまで、漠然とした概念である「前がん病変」について、HE染色で正常粘膜と差が有る無しに関わらず「テロメアが短縮し(=老化が促進され)テロメア機能不全(=染色体の不安定性)のある状態」と定義することを、この論文中で提案しています。すでに口腔内、食道、バレット食道、皮膚でも証明しました。少なくとも扁平上皮領域では我々の前がん病変の定義”テロメアが短い”は普遍性があるようです。
舌を含めた口腔内の扁平上皮がんは高齢者に多い「がん」です。前がん病変といわれる白板症や扁平上皮がんの一部は肉眼で白く見えます。口の中は食道や胃などと異なり自分でも鏡で見ることができます。歯磨きの時などに時々気をつけて見てみて下さい。口の中の粘膜に白い部分を見つけたら、かかりつけの歯科・口腔外科医に一度相談されることをお勧めします。
図1

図1説明:口腔底部に認められた白板症 比較的境界明瞭な白色の病変が認められます。(J Oral Pathol Med. 2012; in press)
図2
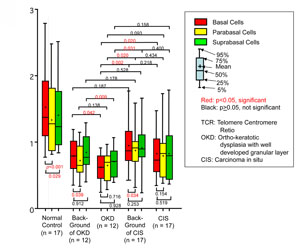 図2説明:口腔粘膜のテロメア長解析結果を箱ヒゲグラフに表したものです。左から、正常成人、白板症の周囲上皮、白板症の細胞、上皮内癌の周囲上皮、上皮内癌の細胞の解析結果で、赤色が基底細胞、黄色が傍基底細胞、緑色が棘細胞を表しています。白板症と上皮内癌以外では基底細胞と傍基底細胞の比較で基底細胞が有意に長く、基底細胞で比較すると白板症や上皮内癌は正常成人より明らかにテロメアが短く、病変部だけでなく白板症や上皮内癌の周囲上皮においてもテロメアが短縮していることがわかります。(J Oral Pathol Med. 2012; in press)
図2説明:口腔粘膜のテロメア長解析結果を箱ヒゲグラフに表したものです。左から、正常成人、白板症の周囲上皮、白板症の細胞、上皮内癌の周囲上皮、上皮内癌の細胞の解析結果で、赤色が基底細胞、黄色が傍基底細胞、緑色が棘細胞を表しています。白板症と上皮内癌以外では基底細胞と傍基底細胞の比較で基底細胞が有意に長く、基底細胞で比較すると白板症や上皮内癌は正常成人より明らかにテロメアが短く、病変部だけでなく白板症や上皮内癌の周囲上皮においてもテロメアが短縮していることがわかります。(J Oral Pathol Med. 2012; in press)
-
- 胆道閉鎖症患児の肝細胞のテロメアは短縮している
Hepatocellular telomere length in biliary atresia measured by Q-FISH. Sanada Y, Aida J, Kawano Y, Nakamura K, Shimomura N, Ishikawa N, Arai T, Poon SS, Yamada N, Okada N, Wakiya T, Hayashida M, Saito T, Egami S, Hishikawa S, Ihara Y, Urahashi T, Mizuta K, Yasuda Y, Kawarasaki H, Takubo K. World J Surg. 2012; 36: 908-916
-
本研究では、肝移植時に摘出した胆道閉鎖症患児の肝臓と同世代の正常児の肝臓を標本として、組織Q-FISH法でテロメア長を比較し、胆道閉鎖症患児の肝細胞のテロメア長が明らかに短い(老化が進んでいる)ことを証明しました。胆道閉鎖症は出生1万に1人の稀な疾患であり、出生後から乳児早期に発症する閉塞性黄疸を主徴とし、放置すれば胆汁うっ滞性肝硬変から肝不全に進行し死亡する小児難治性疾患のひとつです。現在、小児生体肝移植の対象となる疾患の約70%が胆道閉鎖症でありますが、移植実施時期に関しては、施設間で異なるのが現状であり、蛋白合成能やビリルビン値、凝固機能などで代用(PELDスコア:Pediatric end-stage liver disease score)することにより予備能を把握しています。本研究では、PELDスコアが低く、肝予備能が保たれていると考えられていた胆道閉鎖症患児においてもテロメア長が正常児に比べて有意に短縮しておりました。細胞老化や細胞障害の指標とされるテロメア長が短い胆道閉鎖症患児は、将来的に肝不全に至る可能性が高いことを示しております。したがって、本研究は、テロメア長の測定により、肝細胞の障害程度や肝予備能を把握することができ、より正確で具体的な肝移植適応時期を決定できることを示した世界で初めての研究です。
図1
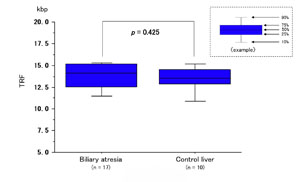
図2
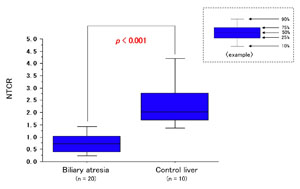
解説:胆道閉鎖症患児と正常対照群肝組織のテロメア長の解析結果を箱ヒゲグラフで表したものです。サザンブロット法による解析結果(上:図1)では、組織全体でテロメア長を解析するため、多量の炎症性細胞(リンパ球や組織球)、線維芽細胞が含まれる胆道閉鎖症の肝組織では、正常組織と差が見られません。しかし、組織切片を用いたFISH法による解析結果(下:図2)では炎症性細胞や線維芽細胞を除外して肝細胞のみを解析でき、正常対照群よりも患児の肝細胞ではテロメア短縮が起きていることがわかります。
-
- 過度のアルコール摂取はテロメアを短縮させがんを発生させる
Alcoholics show reduced telomere length in the oesophagus. Junko Aida, Akira Yokoyama, Naotaka Izumiyama-Shimomura, Ken-ichi Nakamura, Naoshi Ishikawa, Steven SS Poon, Mutsunori Fujiwara, Motoji Sawabe, Masaaki Matsuura, Tomio Arai, Kaiyo Takubo. J Pathol. 2011; 223: 410-416.
食道や口腔の扁平上皮がんを持つヒトは、がんのないヒトより非がん部の上皮のテロメアが短く、染色体不安定性が増加しています。今回、テロメアを短縮させる原因を検討するために、アルコール症患者(アルコール多飲者)の食道上皮について、テロメアを測定してみました。アルコール症患者では食道がんが多発します。その結果、アルコール症患者の食道上皮はテロメアが短縮していました。従って、過度のアルコール摂取はテロメアを短縮させることを証明しました。食道がんにならないようにするためには、アルコールの過剰な摂取は避けなくてはいけません。J Pathol は、現在病理学領域で最もインパクトファクターの高い雑誌で、この雑誌に論文が掲載されグループ全員は大喜びしました。また、この論文の内容は共同通信社を通じて、全国の日刊紙の記事となりました。
図1
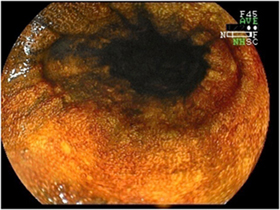 図2
図2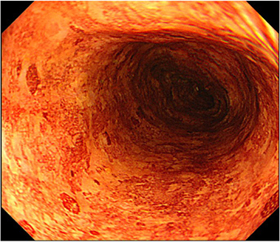
解説:
食道のヨード染色後の内視鏡像。ヨード染色を行なうと、正常上皮(上;図1)であれば、一様に全体が褐色に染まります。しかし、多くのアルコール症患者では、まだらです(下;図2)。まだら食道のテロメア長は短く、染色体の不安定性の存在を示しています。(J Pathol 2012;223: 410-416)
-
- 食道がんは食道上皮のテロメアが短くなると発生する
Q-FISH analysis of telomere and chromosome instability in the oesophagus with and without squamous cell carcinoma in situ. Kaiyo Takubo, Masahiro Fujita, Naotaka Izumiyama, Ken-ichi Nakamura, Naoshi Ishikawa, Steven S Poon, Mutsunori Fujiwara, Motoji Sawabe, Masaaki Matsuura, Heike Grabsch, Tomio Arai1, Junko Aida. J Pathol. 2010; 221: 201-209.
食道の扁平上皮がんは高齢者に好発する「がん」です。この「がん」は30歳代までは、まず発生しません。では、なぜ高齢者でこの「がん」が発生してくるのでしょうか。この論文の中で、「がん」を持つ食道上皮はテロメアが短いこと、染色体の不安定性のあることを証明しました。つまり、「がん」の発生している上皮では、老化が加速していました。この論文によりテロメアが短くなると「がん」の発生の危険があるといえました。今後は加齢以外のいかなる因子がテロメアを短くするか研究します。
-
- 舌がんなどの口腔がんは口腔上皮のテロメアが短くなると発生する
Telomere lengths in the oral epithelia with and without carcinoma. Junko Aida, Toshiyuki Izumo, Naotaka Shimomura, Ken-ichi Nakamura, Naoshi Ishikawa, Masaaki Matsuura, Steven SS Poon, Mutsunori Fujiwara, Motoji Sawabe, Tomio Arai, Kaiyo Takubo. Eur J Ca. 2010; 46: 430-438. (さらに…)
舌がんなどの口腔の扁平上皮がんは、現在世界的に増加傾向にあります。臓器としては8番目に多い「がん」と言われています。口腔がんも他の臓器と同様、30歳代までの発症はごく稀です。高齢者においてこの「がん」が発生してくる理由として、高齢者ではテロメアが短縮し、上皮細胞の染色体が不安定となっていることが考えられます。この論文では「がん」を持つ口腔上皮は「がん」のない人に比べてテロメアが短く、染色体の不安定性があることを証明しています。つまり、「がん」の発生してくる人は老化が加速しているともいえます。今後は加齢以外のどのような原因でテロメアが短縮するのかについて研究して行きます。