がん幹細胞研究
がん幹細胞は自己複製能と、多分化能を持っています。がん幹細胞は通常はあまり増殖しないため、抗がん剤や放射線治療が効きにくく、がん幹細胞が生き残るとがんは再発してしまいます。また、がん幹細胞は動きやすい性質があり、がん周囲の血管やリンパ管に侵入して移動し、他の臓器にがんの転移をおこすと考えられています。
がん幹細胞には、他のがん細胞に比べて特に多く発現しているがん幹細胞マーカーと呼ばれるタンパクが知られています。がん幹細胞マーカーはがん幹細胞の目印になることから、がんの早期診断やがん幹細胞を標的とした治療に役立つと考えられています。
私達は膵臓がんについて、①がん幹細胞マーカーの発現と役割、②がん幹細胞の形態学的特徴の解析、③がん幹細胞の抗がん剤耐性や糖鎖解析、④がん幹細胞に有効な薬剤の探索などの研究を行なっています。
論文業績紹介
-
- 膵がん細胞株の3次元培養スフェアに多発嚢胞が形成
Multiple cystic sphere formation from PK-8 cells in three-dimensional culture. Shichi Y, Gomi F, Ueda Y, Nonaka K, Hasegawa F, Hasegawa Y, Hinata N, Yoshimura H, Yamamoto M, Takahashi K, Arai T, Ishiwata T. Biochemistry and Biophysics Reports 32 (2022) 101339
Multiple cystic sphere formation from PK-8 cells in three-dimensional culture – ScienceDirect (さらに…)
-
がん細胞の三次元 (3 D) 培養は、生体内での環境に類似していると考えられています。 最近、私達は上皮系および間葉系の特徴を持つヒト膵臓がん培養細胞株は異なった形のスフェア(浮遊細胞塊)を形成することを報告しました (Scientific Reports 2019, 2021)。上皮間の結合に関与し、上皮細胞のマーカーとしても知られるE-カドヘリンの発現が最も高いPK-8 細胞のみが、3D培養でスフェアの内部に多数の嚢胞を形成していました。 光干渉断層撮影(OCT)で観察すると、スフェアの内部で大小の嚢胞は相互に繋がっていました。 透過型電子顕微鏡でスフェアを形成するとPK-8細胞には、細胞間の弱い接着や細胞の変性、壊死がみられ、細胞質内には分泌顆粒も認められました。PK-8細胞のスフェアのMUC1、MUC5AC、およびアミラーゼの発現は、2D培養した時よりも増加していました。以上より、E-カドヘリンを高発現するPK-8 細胞にはスフェア内に多数の嚢胞がみられ、3D培養によって増加するムチンやアミラーゼが嚢胞形成に関与している可能性が示唆されました。
-
- 膵臓がんの転移促進因子H19の制御機構
Gp130-Mediated STAT3 Activation Contributes to the Aggressiveness of Pancreatic Cancer Through H19 Long Non-Coding RNA Expression. Sasaki N, Hirano K, Shichi Y, Gomi F, Yoshimura H, Matsushita A, Toyoda M, Ishiwata T. Cancers 2022, 14(9), 2055. https://doi.org/10.3390/cancers14092055
-
私達は、現在までに長鎖非コードRNAのH19が膵臓がん細胞の転移に関わることを明らかにしました(Lab Invest. 2018; Oncotarget 2019)。しかし、H19の発現制御機構は不明でした。3次元(3D)培養によって形成されたヒト膵臓がん培養細胞の細胞塊には幹細胞が多く含まれ(幹細胞様細胞)、gp130/STAT3経路が活性化していました。膵臓がん幹細胞様細胞に gp130阻害剤を添加しgp130/STAT3経路を阻害すると、増殖抑制、幹細胞マーカーやMT1-MMPの低下がみられ、がん細胞の浸潤能が抑制されました。gp130/STAT3経路は、膵臓がん幹細胞様細胞におけるトランスフォーミング増殖因子(TGF) β-受容体IIの発現を維持することにより、上皮間葉転換(EMT)に関わることが明らかになりました。さらに、gp130/STAT3経路が膵臓がん幹細胞様細胞のH19発現に関与し、クロマチン免疫沈降によりリン酸化-STAT3がH19のプロモーター領域にアクセスしてH19の転写に寄与することを解明しました。今回の研究から、gp130/STAT3経路の阻害は幹細胞を含む膵臓がんを標的とした新たな治療法となることが期待されます。
-
- ガングリオシドによるがんのシグナル伝達制御(総説)
Gangliosides as signal regulators in cancer. Norihiko Sasaki, Masashi Toyoda, Toshiyuki Ishiwata. International Journal of Molecular Sciences, 2021, 22 (10), 5076. https://www.mdpi.com/1422-0067/22/10/5076
-
大部分のがんでは、増殖、浸潤、転移に関する細胞内シグナル伝達系に異常が起こっていることが知られています。ガングリオシドはスフィンゴ糖脂質の一種で、がん細胞ではいくつかのシグナル伝達分子がガングリオシドの発現レベルによって正または負に調節され、悪性動態を促進しています。さらに、いくつかのガングリオシドに対する抗体は、ガングリオシドを発現しているがん細胞に対して細胞傷害効果を有することが報告されています。この総説では、がん細胞のシグナル伝達の調節におけるガングリオシドの関与を紹介し、ガングリオシドを発現するがんを標的とする治療法の可能性について記載しました。
-
- ポリビニルアルコールと膵臓がん幹細胞の論文がHeliyon誌に掲載されました。
Polyvinyl alcohol increased growth, migration, invasion, and sphere size in the PK-8 pancreatic ductal adenocarcinoma cell line. Fujiya Gomi, Norihiko Sasaki, Yuuki Shichi, Fuuka Minami, Seiichi Shinji, Masashi Toyoda, Toshiyuki Ishiwata. Heliyon 7 (2021) e06182. https://doi.org/10.1016/j.heliyon.2021.e06182 (さらに…)
-
ポリビニルアルコール(PVA)は糊の成分として知られ、点眼薬や人工軟骨など医療分野にも広く利用されています。近年、PVAが様々な血液細胞に分化することができる、造血幹細胞(ぞうけつかんさいぼう)を増加させる事が報告されました。膵臓がんには、がんの親玉と言われるがん幹細胞が存在すると考えられています。がん幹細胞は、自分と同じ細胞を作る自己複製能と、他の様々ながん細胞を生み出す多分化能があり、がんの再発や転移に重要な役割を果たしていると考えられています。しかし、がん幹細胞は、がんの中でとても数が少ないため研究が困難で、その性質は未だ良くわかっていません。
この研究では、PVAが膵臓がんのがん幹細胞を増やすことができるかについて、平面的にがん細胞を培養する2次元培養と、より生体に近い立体的な培養(3次元培養)で研究しました。2次元培養で、PVAによって膵臓がん細胞は凝集しコロニーのような形態を示しました。PK-8というヒト膵臓がん培養細胞株は、PVA投与により増殖能、遊走能、浸潤能が亢進し、がん幹細胞に高発現するとされる7種類のがん幹細胞マーカーの4種類が増加しました。一方、3次元培養ではPVAによりPK-8細胞の浮遊細胞塊(スフェア)は大きなこん棒状の構造を示し、増殖能も亢進していました。しかし、これらのスフェアでは、がん幹細胞マーカーの増加はみられず、がん幹細胞で高発現するとされる薬剤排泄トランスポーターの増加も認めませんでした。
ヒト膵臓がん培養細胞株のPK-8細胞の2次元培養では、PVAによりがん幹細胞が増加する可能性はあるものの、3次元培養ではがん幹細胞以外のがん細胞の増加が著明であることが明らかとなりました。
ポリビニルアルコールの添加によって大きな棍棒状、連珠状となったヒト膵癌培養細胞株のPK-8細胞のスフェア(浮遊細胞塊). 緑:E-cadherin, 青:核. Nikon A1 HD25 Maximum Intensity Projection (MIP)画像.

-
- 膵臓がんにおける老化細胞除去療法の可能性ーFGFR4阻害剤のBLU9931は増殖と浸潤を抑制するとともに膵臓がん細胞を老化誘導する
FGFR4 Inhibitor BLU9931 Attenuates Pancreatic Cancer Cell Proliferation and Invasion While Inducing Senescence: Evidence for Senolytic Therapy Potential in Pancreatic Cancer. Norihiko Sasaki N, Fujiya Gomi , Hisashi Yoshimura, Masami Yamamoto, Yoko Matsuda, Masaki Michishita, Hitoshi Hatakeyama, Yoichi Kawano, Masashi Toyoda, Murray Korc, Toshiyuki Ishiwata. Cancers (Basel). 2020 Oct 14;12(10):2976. doi: 10.3390/cancers12102976. PMID: 33066597. https://www.mdpi.com/2072-6694/12/10/2976
-
- ヒト膵癌細胞株MIA PaCa-2に髙発現するガングリオシドGM-2は成長・浸潤に関与する
Ganglioside GM2, highly expressed in the MIA PaCa-2 pancreatic ductal adenocarcinoma cell line, is correlated with growth, invasion, and advanced stage. Norihiko Sasaki, Kenichi Hirabayashi, Masaki Michishita, Kimimasa Takahashi, Fumio Hasegawa, Fujiya Gomi, Yoko Itakura, Naoya Nakamura, Masashi Toyoda, Toshiyuki Ishiwata. Scientific Reports. 2019 Dec 18;9(1):19369. https://pubmed.ncbi.nlm.nih.gov/31852956/ (さらに…)
-
糖脂質の1群であるガングリオシドGM2の発現を8種類のヒト膵臓がん培養細胞で調べたところ、MIA PaCa-2細胞で最も高い発現がみられました。GM2 陽性の膵臓がん細胞は、GM2陰性細胞よりも増殖が速く、GM2陰性膵癌細胞を3次元培養すると、大部分の癌細胞がGM2を発現するようになり、癌幹細胞との関連が示唆されました。GM2の発現を抑制することで、TGF-beta 1シグナルと上皮間葉転換様分化を抑制し、膵癌細胞の浸潤を阻害することができました。ヌードマウスに移植したGM2陽性膵臓がん細胞は、GM2陰性細胞よりも高い発生率で、より大きな腫瘍を皮下に形成しました。発症年齢が若く、腫瘍径が大きく、病期が進行し、組織学的な悪性度が高いヒト膵臓がん患者で、有意にGM2の発現が増加していました。GM2が膵臓がん細胞の表面に発現していることから、GM2を標的とした膵臓がんの早期診断法の開発に繋がることが期待されます。さらに、光免疫療法などの細胞表面抗原を利用した新たな膵臓がん治療にもGM2が役立つと考えられます。
-
- 3次元培養により上皮系または間葉系性質を有する膵がんの形態、機能の相違が明瞭となる
Enhanced morphological and functional differences of pancreatic cancer with epithelial or mesenchymal characteristics in 3D culture. Shichi Y, Sasaki N, Michishita M, Hasegawa F, Matsuda Y, Arai T, Gomi F, Aida F, Takubo T, Toyoda M, Yoshimura H, Takahashi K, Ishiwata T. Scientific Reports. 2019 Jul 26;9(1):10871. doi:10.1038/s41598-019-47416-w. https://www.nature.com/articles/s41598-019-47416-w
-
本論文では膵がん細胞を立体的に培養(3次元培養)し、人体内に類似した環境で膵がん細胞の形態と機能的な特徴を解析しました。その結果、①通常の接着培養下で膵がん細胞には上皮様の性質を示すがん細胞と、間葉系の性質を示すがん細胞の2種類が存在することがわかりました。②上皮様の膵がん細胞は3次元培養で、球形の浮遊細胞塊(スフェア)を形成し表面を覆う扁平ながん細胞が認められました。上皮様の膵がん細胞には分泌顆粒や微絨毛が多く、Cytokeratin 7、トリプシンなどを発現しており正常の膵臓細胞への分化がみられました。細胞増殖マーカーのKi-67はスフェア周囲を被覆する扁平ながん細胞にのみ認められ、増殖極性が確認されました。③間葉系の性質を示す膵がん細胞は3次元培養で、不整形のスフェアを形成し分化成熟傾向は乏しく、Ki-67陽性細胞はスフェア全体にびまん性に分布し増殖の極性は認められませんでした。④上皮様性質を示す膵がん細胞のPK-1細胞は、Smad4が免疫染色で陰性で、TGF-β1の投与により上皮間葉転換(EMT)が誘導されませんでした。⑤間葉系性質を示す膵がん細胞のPANC-1細胞はSmad4が陽性でTGF-β1投与によりEMTが誘導されました。3次元培養により、膵がん細胞の上皮間葉系性質の違いが明瞭になりました。膵がん細胞の上皮様形態と機能の保持には、TGF-βシグナル伝達系が関与していることが示唆されました。3次元培養を用いた研究は多様性を有する膵がんの個別診断や、個別治療法の開発に有用であることが明らかになりました。
-
- 血清を含む培地で培養されたヒト膵癌細胞のスフェアは大型で、癌幹細胞マーカーの発現も増加している
Fetal bovine serum enlarges the size of human pancreatic cancer spheres accompanied by an increase in the expression of cancer stem cell markers. Norihiko Sasaki, Masashi Toyoda, Fumio Hasegawa, Masakazu Fujiwara, Fujiya Gomi, Toshiyuki Ishiwata. Biochem Biophys Res Commun. 2019 Jun 18; 514 (1): 112-117, https://pubmed.ncbi.nlm.nih.gov/31027735/
-
低接着性のプレートで膵癌細胞を培養すると、スフェアと呼ばれる浮遊した癌の細胞塊が形成されます。通常、epidermal growth factor (EGF)とfibroblast growth factor -2 (FGF-2)を加えた無血清培地で培養することで、癌幹細胞を多く含むスフェアができると考えられています。私達は、膵癌細胞を10%ウシ胎児血清の入った培地で培養すると形態は同様で、よりサイズの大きなスフェアが形成されることを見出しました。PANC-1とPK-1というヒト膵癌培養細胞を血清入り培地で培養すると、両者とも大きなスフェアを形成し、PK-1細胞ではスフェアの辺縁が扁平な癌細胞に被覆されていました。癌幹細胞に多く発現する癌幹細胞マーカーの発現レベルは、半数の癌幹細胞マーカーが増殖因子入り培地で高く、半数が血清を含む培地で高いことが明らかとなりました。これらのことから血清を含む培地で培養したスフェアにも癌幹細胞は多く含まれており、癌幹細胞の解析や癌幹細胞に対する治療法の開発に重要であると考えています。

-
- がん幹細胞と正常幹細胞における糖鎖の比較(総説)
Comparison of functional glycans between cancer stem cells and normal stem cells. Sasaki N, Itakura Y, Gomi F, Hirano K, Toyoda M, Ishiwata T. Histol Histopathol. 2019 Apr 26:18119. doi: 10.14670/HH-18-119.
-
がん幹細胞 (Cancer Stem Cell/CSC) は、腫瘍内に少数存在しており幹細胞性(自己複製能と多分化能)を有し、がんの進展を促進します。がん幹細胞は、従来の治療法に対する耐性やがんの再発に重要な影響を及ぼしますが、詳細な特徴は未だ明らかではありません。がん幹細胞は、新たながん治療の標的と考えられています。これまでに、糖鎖を含む多くの細胞表面マーカーが、がん幹細胞の同定と分離に使用されてきました。細胞表面の糖鎖は一部の細胞の良く知られたマーカーで、細胞シグナル伝達の調節などの重要な役割も果たしています。胚性幹細胞や組織幹細胞などの正常の幹細胞では、未分化状態の糖鎖マーカーが特定されています。これらのマーカーは、主に幹細胞性の維持に必要なシグナル伝達経路を調節していることが知られています。一方で、がん幹細胞に特有の糖鎖は未だ明らかとなっていません。この論文では、がん幹細胞と正常な幹細胞における、糖鎖を介したシグナル伝達経路についての機能的な共通性を紹介しています。 がん幹細胞に特有の糖鎖の同定は、がんの早期診断と根治的治療につながる可能性があると考えています。
-
- 膵がんのがん幹細胞:その特徴と検出方法(総説)
Pancreatic cancer stem cells: features and detection methods. Toshiyuki Ishiwata, Yoko Matsuda, Hisashi Yoshimura, Norihiko Sasaki, Shunji Ishiwata, Noshi Ishikawa, Kaiyo Takubo, Tomio Arai, Junko Aida. Pathol Oncol Res. 2018 Oct;24(4):797-805. doi: 10.1007/s12253-018-0420-x. Epub 2018 Jun 8. Review. PubMed PMID: 29948612.
-
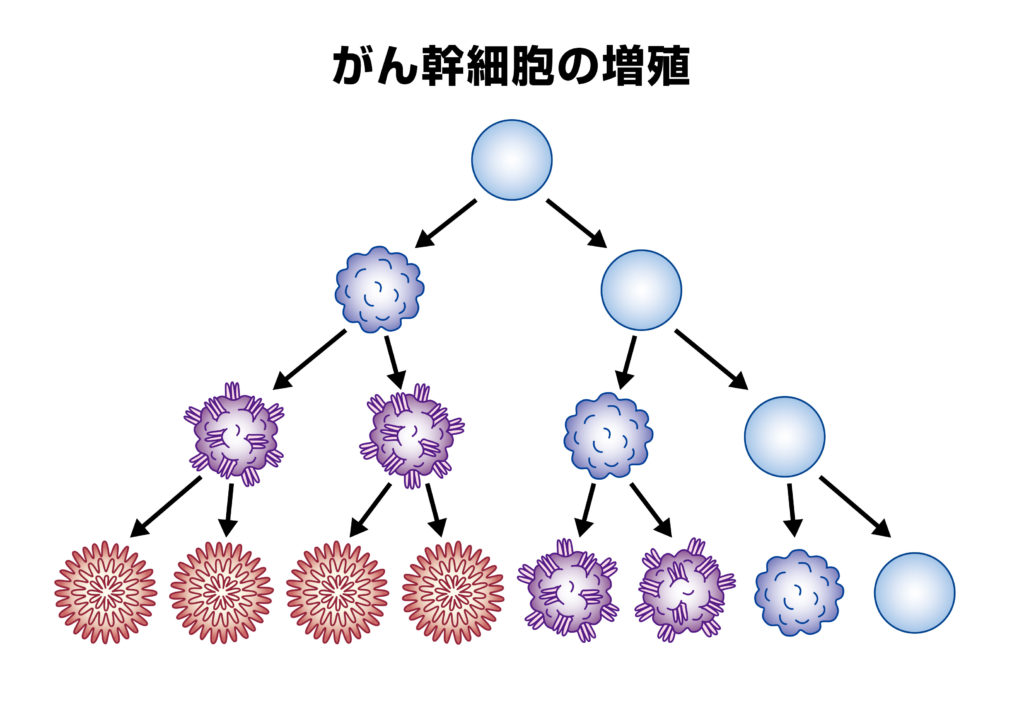
がん幹細胞 (Cancer Stem Cell/CSC) は多分化能と自己複製能を有するがん細胞で、腫瘤の形成に重要な役割を果たしていると考えられています。がん幹細胞は、膵がん(Pancreatic Ductal Adenocarcinoma/PDAC)の発がんや転移、抗がん剤や放射線治療への抵抗性にも関与しています。がん幹細胞を分離、同定する主な方法として以下の3つの方法が現在広く用いられています。①がん幹細胞マーカーと、②低接着プレートで培養して形成されるスフェア(浮遊細胞)、③細胞内から細胞外への薬剤排泄ポンプ機能が高いSide Population (SP)細胞です。膵がんのがん幹細胞マーカーとしてはCD133, CD24, CD44, CXCR4, EpCAM, ABCG2, c-Met, ALDH-1, nestinなどが知られています。一方で、どのマーカーが膵がんのがん幹細胞に特異的なのかや、がん幹細胞にはこれらのマーカーが単独で発現しているのか複数が同時に発現しているのかなど未だ明らかではありません。がん幹細胞を分離して、その特徴を解析することはがん幹細胞に特異的な治療法の開発に繋がり、膵がんの予後の向上に寄与すると考えられます。この論文では、膵がんのがん幹細胞の特徴とその検出方法について紹介しています。
-
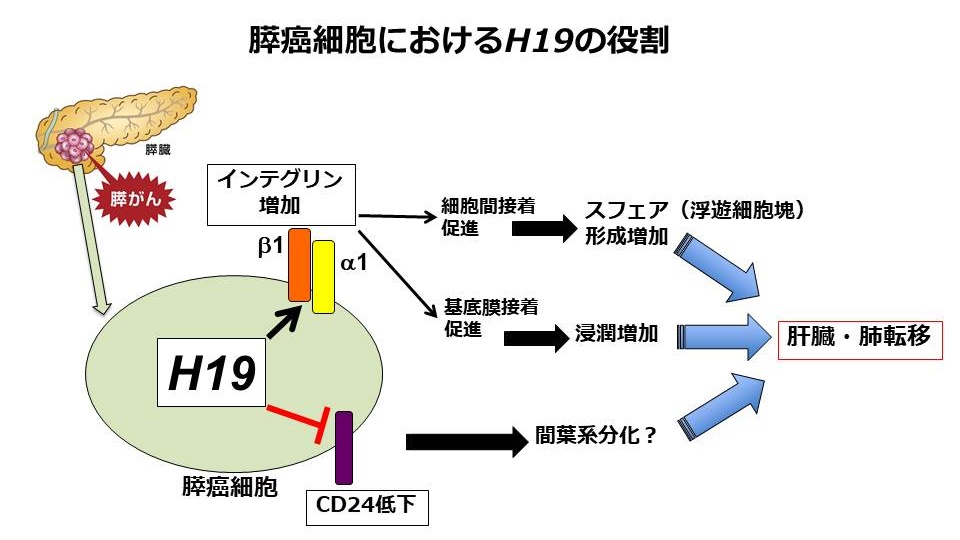
- 長鎖非コードRNAのH19は膵癌のスフェア形成と、CD24およびインテグリンを介した浸潤に関与する
H19 long non-coding RNA contributes to sphere formation and invasion through regulation of CD24 and integrin expression in pancreatic cancer cells. Norihiko Sasaki, Masashi Toyoda, Hisashi Yoshimura, Yoko Matsuda, Tomio Arai, Kaiyo Takubo, Junko Aida, Toshiyuiki Ishiwata. Oncotarget. 2018 Oct 5;9(78):34719-34734. https://pubmed.ncbi.nlm.nih.gov/30410672/
-
私達は、以前H19というタンパクに翻訳されない長鎖非コードRNAが膵癌の転移に重要な役割を果たしており、H19の発現を減少させることで膵癌の転移を抑制できることを動物実験で報告しました。この研究では、H19がどのような機序で、膵癌の転移に関与しているかを研究しました。その結果H19はインテグリンとCD24を介して、膵癌細胞の接着を促進することがわかりました。H19の過剰発現膵癌細胞株に、インテグリンβ1抗体を投与することで、膵癌細胞のスフェア形成や浸潤能が低下しました。この研究でH19が膵癌の癌幹細胞の自己複製や浸潤能に重要な役割を果たしており、これにより膵癌の浸潤転移を促進していることを解明しました。H19が今後、膵癌の転移抑制に向けた新たな治療標的となると考えています。
-
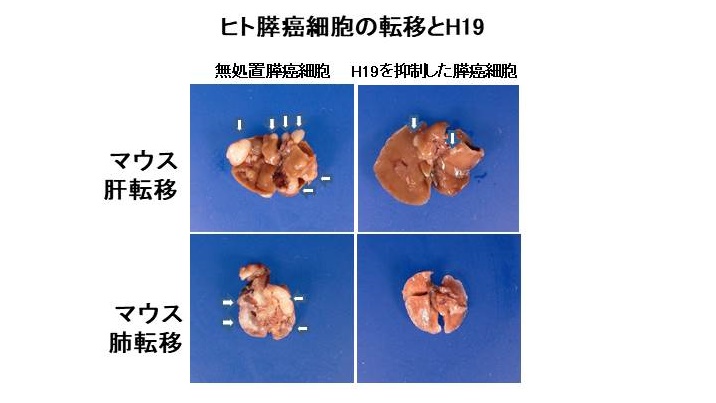
- 長鎖非コードRNA, H19の発現を減少させることで膵癌の転移を抑制
Reduced expression of the H19 long non-coding RNA inhibits pancreatic cancer metastasis. Hisashi Yoshimura, Yoko Matsuda, Masami Yamamoto, Masaki Michishita, Kimimasa Takahashi, Norihiko Sasaki, Naoshi Ishikawa, Junko Aida, Kaiyo Takubo, Tomio Arai, Toshiyuki Ishiwata.Lab Invest. 2018 Jun;98(6):814-824. https://pubmed.ncbi.nlm.nih.gov/29581580/
-
H19は胎児期や膀胱癌、乳癌、胃癌、肝癌、前立腺癌や膵癌などで発現が報告されている長鎖非コードRNAです。この研究で、ヒト膵癌細胞を移植したマウスの肺転移巣において移植前のヒト膵癌細胞と比べてH19が82.4倍も増加していることがわかりました。肺転移巣で10倍以上増加しているRNAは11種類でしたが、H19は2番目に増加しており、唯一のタンパクを産生しない非コードRNAでした。H19を増加させた膵癌細胞は移動能が亢進し、逆にH19を減少させると移動能が抑制されることがわかりました。H19を減少させたヒト膵癌細胞をマウスに移植すると、肝転移と肺転移が著明に抑制されることが明らかになりました。ヒト組織での検討で、H19の発現が17%の膵癌患者さんにみられることから、H19が転移に重要な役割を果たしており、H19の抑制が新たな膵癌治療法となる可能性が示唆されました。
-
- 3D培養によって、幹細胞性と抗がん剤耐性を示すABCG2高発現膵癌細胞が誘導
Stemness and anti-cancer drug resistance in ATP-binding cassette subfamily G member 2 highly expressed pancreatic cancer is induced in 3D culture conditions. Norihiko Sasaki, Toshiyuki Ishiwata, Fumio Hasegawa, Masaki Michishita, Hiroki Kawai, Yoko Matsuda, Tomio Arai, Noshi Ishikawa, Junko Aida, Kaiyo Takubo, Masashi Toyoda. Cancer Science 2018 Apr;109(4):1135-1146. doi: 10.1111/cas.13533. Cancer Sci. 2018 Apr;109(4):1135-1146. doi: 10.1111/cas.13533.
-
薬剤排泄に関与するABCG2の、膵癌の癌幹細胞との関連について検討しました。セルソーターによってヒト膵癌細胞をABCG2陽性細胞と陰性細胞に分けると、ABCG2陽性細胞は膵癌細胞の10%程度でした。ABCG2陽性の膵癌細胞は予想に反し、抗癌剤に対する耐性能が高くないことがわかりました。さらに、ABCG2陰性の膵癌細胞の方がスフェア形成能や癌幹細胞マーカーの発現が高く、細胞増殖能や移動能も高いことが明らかになりました。次に3D培養を行なったところ、ABCG2陰性の膵癌細胞から多数のABCG2陽性の細胞を含むスフェアが作られました。これらのABCG2陽性細胞からなるスフェアは癌幹細胞マーカーの発現が高く、抗癌剤に耐性であることがわかりました。2D培養でみられるABCG2陽性細胞には幹細胞性や悪性能は少ないものの、3D培養で形成されたABCG2陽性細胞のスフェアは幹細胞性が高く、抗癌剤耐性であることが明らかになりました。これらのことから、ABCG2陰性の膵癌細胞にはABCG2陽性の細胞を作る能力があり、ABCG2陽性の膵癌細胞の悪性能は周囲の環境によって変化すると考えられました。
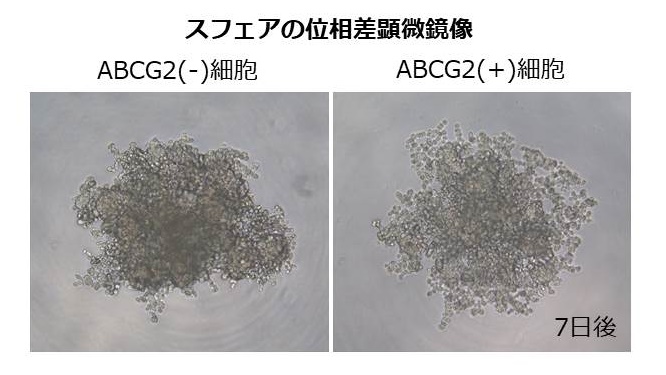
-
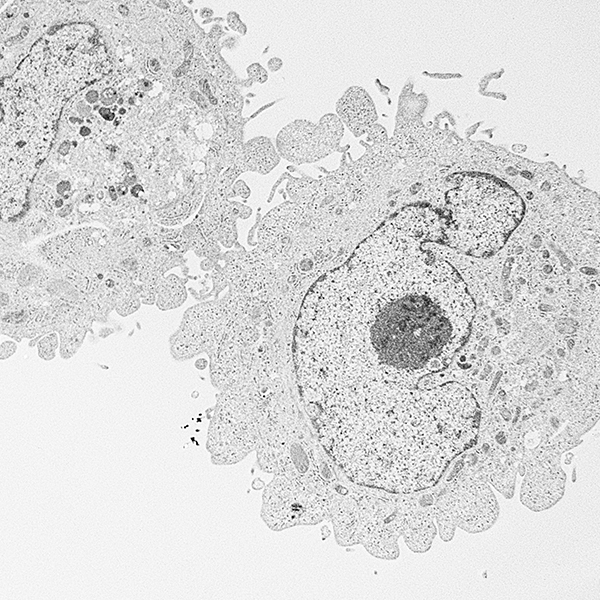
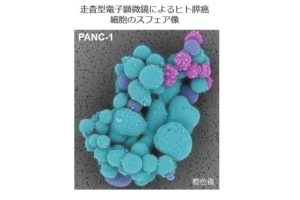
- ヒト膵癌のスフェアを形成する癌細胞の電子顕微鏡による解析
Electron microscopic analysis of different cell types in human pancreatic cancer spheres. Toshiyuki Ishiwata, Fumio Hasegawa, Masaki Michishita, Norihiko Sasaki, Naoshi Ishikawa, Kaiyo Takubo, Yoko Matsuda, Tomio Arai, Junko Aida. Oncol Lett. 2018 Feb;15(2):2485-2490. doi: 10.3892/ol.2017.7554.
-
癌幹細胞は自分と同じ細胞を作ることができる自己複製能と、様々なタイプの癌細胞を作る多分化能を持つ特別な癌細胞と考えられています。癌幹細胞は化学療法や放射線治療に抵抗性を示し、発癌や癌の転移、再発に重要な役割を果たしています。低接着プレート上で癌細胞を培養すると、スフェアと呼ばれる浮遊細胞塊が形成され、このスフェアの中には多くの癌幹細胞が含まれていると言われています。しかし、スフェアの微細構造についてはほとんど報告がないため、ヒト膵癌細胞のPANC-1細胞のスフェアを走査型電子顕微鏡(SEM)と、透過型電子顕微鏡(TEM)で観察しました。1週間後に形成されたスフェアは接着状態で培養したPANC-1細胞に比べて、nestin, Sox2, CD44v9等の癌幹細胞マーカーが多く発現していました。SEMによる観察ではスフェアはぶどうの房状の形態を示しており、癌細胞の表面は平滑のものから凹凸のあるものなど様々でした。TEMの観察では、癌細胞の表面は平滑なもの、不規則な大きな突起のあるもの、突起と少数の微絨毛のあるもの、多数の微絨毛に覆われているものの4種類が認められました。スフェア内のこれらの膵癌細胞の形態変化が、癌幹細胞からより分化した癌細胞への分化段階を示している可能性があると考えています。
がんの上皮間葉転換研究
上皮細胞と間葉系細胞はそれぞれが分化した細胞で、お互いの細胞に変化することはないと考えられてきました。しかし近年、胎児の発生段階や、創傷治癒の過程で上皮細胞が間葉系細胞のような形態と性質に変化することがあることが解明され、「上皮間葉転換(じょうひかんようてんかん)/EMT」と呼ばれています。
近年、がん細胞もEMTをおこすことが明らかとなり、がんの転移や再発、抗がん剤耐性に重要な役割を果たしていることが報告されています。私たちはEMTの制御が新たな膵臓がんの治療法となる可能性を考え、EMTの機序の解明と、抗がん剤耐性について研究を進めています。
論文業績紹介
-
- Artificial intelligence-based analysis of time-lapse images of sphere formation and process of plate adhesion and spread of pancreatic cancer cells.
Artificial intelligence-based analysis of time-lapse images of sphere formation and process of plate adhesion and spread of pancreatic cancer cells. Shichi Yuuki, Gomi Fujiya, Hasegawa Yasuko, Nonaka Keisuke, Shinji Seiichi, Takahashi Kimimasa, Ishiwata Toshiyuki. Front Cell Dev Biol. 2023 Nov 17;11:1290753. https://www.frontiersin.org/articles/10.3389/fcell.2023.1290753/full (さらに…)
-
研究の背景: 膵癌の多くは膵管癌(PDAC)で、三次元(3D)培養で形成されるスフェアの形態や抗癌剤の効果は、上皮系のPDAC細胞株と間葉系のPDAC細胞株で行なっていることを、最近我々は明らかにした。ヒトの膵臓組織では膵癌細胞は立体的な腫瘍塊を形成し、周囲の組織に遊走浸潤し他の臓器に遠隔転移する。現在まで、個々の癌細胞の水平方向や垂直方向への移動能については、多くの測定方法が知られている。しかし塊状となった腫瘍の周辺組織への遊走能を、in vitroで検討する有効な方法は存在しない。我々は、3次元培養で形成したスフェアを用いて、上皮系と間葉系のPDAC細胞株の腫瘍塊の周囲への遊走能を検討した。
研究の方法: 上皮系のPDAC細胞株5種類と間葉系のPDAC細胞株3種類を用いて低接着プレートでのスフェアの形成過程と、形成したスフェアの通常プレートへの接着・遊走過程をタイムラプス撮影し、プレートへ接着したスフェアの面積をAIのディープラーニング法を用いて画像解析した。
結果: 免疫細胞化学染色により、E-カドヘリンは上皮系のPDACスフェアに、間葉系のPDACスフェアにはビメンチンが高発現していることを2次元培養で確認した。低付着プレートを用いたスフェアの形成過程では、ほとんどの上皮系のPDAC細胞株は最初にスフェア面積が減少し、その後で表面の被覆細胞が融合し滑らかなスフェア表面へと変化した。間葉系のPANC-1細胞とMIA PaCa-2細胞は、スフェア面積はほとんど減少せず、スフェア表面の融合領域もわずかであった。形成されたPDACスフェアを通常の培養プレート移すと、E-カドヘリン発現が最も高く、スフェアの表面が滑らかな上皮系のPK-8細胞のスフェアは60時間後でも通常のプレートに接着せず、上皮系のPK45-PとT3M-4細胞のスフェアではプレートに接着した面積は少なかった。一方で、間葉系のPANC-1とKP4細胞のスフェアは通常のプレートへ早期から接着し、接着した面積も広かった。
結語: 3次元培養で形成したスフェアを通常の培養プレートに播種することで、腫瘍塊の周囲へ遊走能の違いを明らかにすることができた。各PDAC細胞株によって形成されたスフェアの周囲への遊走能には差があり、間葉系のPDAC細胞株は上皮系のPDA細胞株のスフェアよりも遊走能が高かった。
-
- 2次元培養と3次元培養における上皮系と間葉系膵臓がん細胞株の特徴についての総説
Epithelial and Mesenchymal Features of Pancreatic Ductal Adenocarcinoma Cell Lines in Two-and Three-Dimensional Cultures. Shichi Y, Gomi F, Sasaki N, Nonaka K, Arai T and Ishiwata T. J. Pers. Med. 2022, 12(5), 746. Review https://www.mdpi.com/2075-4426/12/5/746
-
約380種類のヒト膵癌培養細胞株 (PDAC細胞株)が患者さんから樹立されていますが、これらの細胞株間の性質の違いは良くわかっていません。最近、私達はPDAC細胞株には上皮系の性質を有する細胞株と、間葉系の性質を示す細胞株が存在し、両者の細胞株を立体的に培養すると(3次元培養)、形態と機能、抗がん剤の効果の違いが明瞭になることを発見しました。今後、上皮系と間葉系のPDAC細胞株と間質細胞を一緒に培養する3次元共培養法が、新規治療薬の開発などに重要な役割を果たす可能性があると考えられます。
-
- 2次元培養と3次元培養による膵臓がん培養細胞株の形態・機能変化と薬剤感受性
Morphofunctional analysis of human pancreatic cancer cell lines in 2- and 3-dimensional cultures. Fuuka Minami, Norihiko Sasaki, Yuuki Shichi, Fujiya Gomi, Masashi Michishita, Kozo Ohkusu-Tsukada, Masashi Toyoda, Kimimasa Takahashi, Toshiyuki Ishiwata. Scientific Reports, 2021 Mar 24;11(1):6775. doi: 10.1038/s41598-021-86028-1
-
膵臓がんは形態的にも機能的にもさまざまながん細胞から構成されています。私達は近年、膵臓がんの上皮や間葉系の性質が2次元培養(2D培養)に比べ3次元培養(3D培養)でより明瞭となることを発見しました(Scientific Reports, 2019)。今回の研究では8種類のヒト膵臓がん培養細胞株を用いて2D培養と3D培養におけるがん細胞の形態的、機能的な違いを検討しました。
2D培養では膵臓がん培養細胞株は類似した形態を示していましたが、E-cadherin高値でVimentin低値の上皮様の性質を有する膵臓がん細胞株(PK-8,PK-45P,PK-59,PK-1,T3M-4)は、3D培養で小型の球形のスフェア(浮遊細胞塊)を形成し全体または一部が扁平ながん細胞で覆われていました。一方で、E-cadherin低値でVimentin高値の間葉系の性質を示す膵臓がん培養細胞株(PANC-1,KP4,MIA PaCa-2)のスフェアは大型で不整形のぶどうの房状構造を示し、周囲を覆う扁平な細胞は認めませんでした。大部分の膵臓がん培養細胞株は増殖している細胞に陽性となるKi-67の陽性率が、2D培養の方が3D培養より高いことがわかりました。2D培養ではびまん性にKi-67陽性の膵臓がん細胞がみられるのに対し、3D培養ではスフェア辺縁部の細胞のみがKi-67陽性となる膵臓がん細胞株がみられました。抗がん剤の効果を3D培養において検討したところ、gemcitabineは上皮様の形質を示す膵臓がん培養細胞に、abraxaneは間葉系形質の膵臓がん培養細胞により有効でした。
これらのことから、膵臓がん培養細胞株の3D培養は多様性の検討に有用であり、膵臓がんの早期診断法や個別化治療の開発に重要と考えられます。
-
- ヒト膵癌細胞株MIA PaCa-2の培地中に浮遊する細胞の性質を解析
Characterization of the metastatic potential of the floating cell component of MIA PaCa-2, a human pancreatic cancer cell line. Norihiko Sasaki, Fujiya Gomi, Fumio Hasegawa, Kazumi Hirano, Masakazu Fujiwara, Toshiyuki Ishiwata. Biochem Biophys Res Commun. 2020, https://www.sciencedirect.com/science/article/abs/pii/S0006291X1932248X
-
MIA PaCa-2細胞は65才、男性の膵管癌から樹立された細胞株で、タイムラプスで経時的に観察すると、プレートに接着した紡錘形のMIA PaCa-2細胞が球形となり細胞分裂して、紡錘形にもどることがわかりました。一方で、一部のMIA PaCa-2細胞には球形のまま存在したり、プレートから剥離して浮遊する細胞もあることが明らかとなりました。この浮遊細胞をflow cytometryで検討したところ約90%が生存しており、浮遊細胞の一部は再びプレートに接着し、紡錘形細胞に変化することを発見しました。このように、細胞の形態を変化させる培地中に浮遊している細胞の性質を解析しました。浮遊細胞は接着細胞に比べ、細胞外基質との接着を担うインテグリン類の発現、薬剤耐性を担うATP-binding cassette (ABC) transportersの発現が低下していました。一方、vimentin以外の検討したepithelial to mesenchymal transition (EMT)マーカーは高発現していました。浮遊細胞はG2/M期の細胞比率が接着細胞より高く、遊走能や細胞間接着は接着細胞よりも低いという特徴がありました。さらに、三次元培養下で浮遊細胞は接着細胞よりも抗がん剤(gemcitabine, 5-FU, and abraxane)に感受性が高いことがわかりました。浮遊細胞はEMT markerが高いところから、今後の転移研究に役立つ可能性があり、3次元培養下で抗がん剤への耐性が低いことからは、細胞の浮遊化に伴い抗がん剤耐性を低下する機構が存在するため、この機構を研究することにより新たな治療方法が見つかる可能性があると考えています。同一細胞でさえ様々な性質を示すという事は、癌という形態的にも機能的にも異なる細胞集団には著しく異なる性質の細胞が混在しており、今後の膵癌研究は、この多様性を考慮すべきであることを強く示しています。
-
- 正常細胞とがん細胞における線維芽細胞増殖因子受容体-2(FGFR-2)の選択的スプライシングの役割について(総説)
Role of fibroblast growth factor receptor-2 splicing in normal and cancer cells. Ishiwata T. Role of fibroblast growth factor receptor-2 splicing in normal and cancer cells. Front Biosci (Landmark Ed). 2018 Jan 1;23:626-639. Review. PubMedPMID: 28930565.
-
高齢者がんを含むさまざまながん細胞には1型から4型の線維芽細胞増殖因子受容体(FGFR-1~4)が発現しています。なかでもFGFR-2は発がんやがんの進展に重要な役割を果たしていることが報告されており、がんの新たな治療標的として注目されています。FGFR-2は膜貫通型の増殖因子受容体で、細胞外ドメインの選択的スプライシングによりIIIbとIIIcのバリアントが存在しています。FGFR-2 IIIbは口腔、食道、胃、大腸、膵臓、肺、乳腺、子宮、前立腺などの上皮細胞に、主に発現しています。一方、FGFR-2 IIIcは間葉系細胞や上皮間葉転換(EMT)をおこした細胞に発現することが報告されています。FGFR-2 IIIbとIIIcに結合する線維芽細胞増殖因子(FGF)の種類が違うことから、がん細胞への作用も変化すると考えられています。近年の研究で、FGFR-2 IIIbからIIIcへの変換が、がんのEMTに伴う悪性度の増加と関連していることが報告されています。この総説では、がん細胞におけるIIIbとIIIcバリアントの発現と役割、制御機構とEMTの関連について紹介しています。